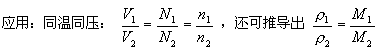第二節 氣體摩爾體積
第一課時
知識目標
使學生在了解氣體的體積與溫度和壓強有密切關系的基礎上,理解氣體摩爾體積的概念。
能力目標
通過氣體摩爾體積的概念和有關計算的教學,培養學生分析、推理、歸納、總結的能力。
情感目標
通過本節的教學,激發學生的學習興趣,培養學生的主動參與意識。
通過教學過程中的設問,引導學生科學的思維方法。
教學重點:氣體摩爾體積的概念
教學難點:相同溫度和壓強下,相同物質的量的任何氣體所占的體積大約相同的原因。
教學方法:設疑、導思、歸納、應用
教學手段:多媒體輔助
教學過程:
[復習提問] 1.1mol物質含有的粒子數約是多少?
2.什么叫摩爾質量?
[引入新課] 前面我們學習的物質的量,它把宏觀上可稱量的物質與微觀粒子聯系起來,宏觀上可感知的除了物質的質量,還有物質所占的體積上節課我們研究了1mol物質所具有的質量,這節課我們來討論1mol物質所占的體積。
[板書] 一、氣體摩爾體積
1.1mol固、液態物質的體積
[提問] 已知物質的質量和密度,怎樣求體積?

[投影] 計算1mol幾種固、液態物質的體積,填表;
|
物質 |
粒子數 |
1mol 物質質量(g) |
20℃密度(g/cm3) |
體積(cm3) |
|
Fe |
6.02×1023 |
56 |
7.8 |
|
|
Al |
6.02×1023 |
27 |
2.7 |
|
|
Pb |
6.02×1023 |
207 |
11.3 |
|
|
H2O |
6.02×1023 |
18 |
1(4℃) |
|
|
H2SO4 |
6.02×1023 |
98 |
1.83 |
學生分組計算出1molFe、Al、Pb、H2O、H2SO4的體積分別為:7.2、10、18.3、18、53.6cm3
[微機顯示] 1mol物質的體積
[板書] 1mol固、液態物質的體積不相同。
2.1mol氣態物質的體積
[微機顯示] 影響氣體體積的因素
指導學生注意觀察分子間平均距離的變化。
[說明] 比較一定質量氣體的體積,必須在相同溫度和壓強條件下。
[板書] 標準狀況:0℃,101kPa
[投影] 計算標準狀況下,1mol H2、O2、CO2氣體的體積,并填表:
|
氣體 |
粒子數 |
1mol物質質量(g) |
密度(g/L) |
體積(L) |
|
H2 |
6.02×1023 |
2.016 |
0.0899 |
|
|
O2 |
6.02×1023 |
32.00 |
1.429 |
|
|
CO2 |
6.02×1023 |
44.01 |
1.977 |
學生分組計算出標準狀況下,1mol H2、O2、CO2的體積分別為:22.4L、22.4L、22.3L
[板書] 在標準狀況下,1mol任何氣體所占的體積都約是22.4L。
[強調] ①標準狀況(0℃,101Kpa)②物質的量為1mol ③任何氣體物質 ④約為22.4L
[展示] 22.4L體積的實物模型
[設疑] 在其它的溫度和壓強下,1mol氣體是否占有大約相同的體積呢?
[板書] 單位物質的量氣體所占的體積叫做氣體摩爾體積。

[提問] 氣體摩爾體積與標準狀況下氣體摩爾體積22.4L/mol是什么關系?
[強調] 22.4L/mol只是在特定條件下的氣體摩爾體積。氣體摩爾體積是在任意溫度、壓強下,氣體體積與氣體物質的量之比。
[設問] 為什么在一定溫度、壓強下,1mol固、液態物質體積不同,而1mol氣體體積都大致相同呢?讓我們從物質的組成和結構上找找原因。
[討論] 決定物質體積的主要因素
[微機顯示] 影響物質體積的因素
[提問] 1.1mol液態水變為1mol水蒸氣分子數是否變化?
2.為什么體積由18mL變為3.06×104mL,體積擴大了1700倍。
[指出] 在粒子數相同的條件下,固、液態物質的體積主要決定于構成物質的粒子的大小,由于構成不同物質的粒子的大小不同,所以1mol固、液態物質的體積不相同;氣體的體積主要決定于粒子間的距離,不同氣體分子間的平均距離大約相等,所以1mol氣體的體積大致相同。
[結論] 在相同的溫度和壓強下,相同體積的任何氣體都含有相同數目的分子。即阿伏加德羅定律。
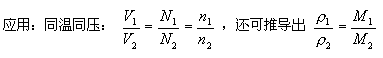
[練習] (投影)下列說法是否正確?如不正確,指出錯誤的原因。
1. 1mol任何氣體的體積都是22.4L。
2. 1molH2的質量是1g,它所占的體積是22.4L/mol。
3. 1mol任何物質在標準狀況時所占的體積都約為22.4L。
4.22.4LO2一定含有6.02×1023個O2。
5.在同溫同壓下,32gO2與2gH2所占的體積相同。
6. 在同溫同壓下,20mLNH3與60mLO2所含的分子個數比為1:3。
(答案:正確的是5.6.)
板書設計:
第二節 氣體摩爾體積
一、氣體摩爾體積
1.1mol固、液態物質的體積
1mol固、液態物質的體積不相同。
2.1mol氣態物質的體積
標準狀況:0℃,101Kpa
在標準狀況下,1mol任何氣體所占的體積都約是22.4L。
單位物質的量氣體所占的體積叫做氣體摩爾體積。
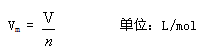
在相同的溫度和壓強下,相同體積的任何氣體都含有相同數目的分子。即阿伏加德羅定律。