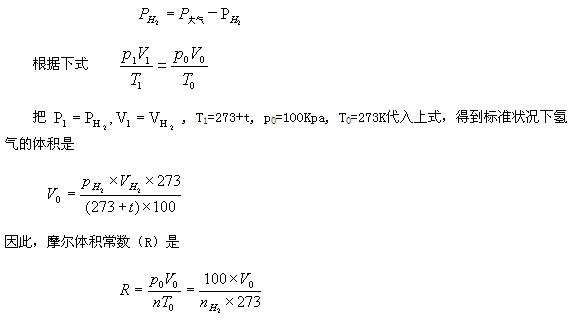[小結] 氣體摩爾體積概念、公式、單位
標準狀況下氣體摩爾體積為22.4L/mol。
[課堂檢測]
1.在相同的條件下,兩種物質的量相同的氣體必然( )
A.體積均為22.4L B.具有相同的體積
C.是雙原子分子 D.具有相同的原子數目
2. 同溫、同壓下,H2和He兩種氣體單質的,如果質量相同,下列說法錯誤的是( )
A.體積比為2 :1 B.原子個數之比為2 :1
C.密度之比為1 :2 D.質子數之比為1 :1
參考答案:1. B 2. B、D
[作業] 質量監測有關習題
板書設計:
二、有關氣體摩爾體積的計算
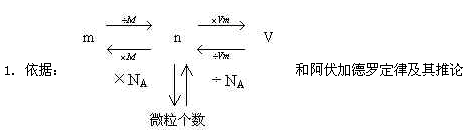
2.類型
(1)標準狀況下氣體的體積與氣體的物質的量、氣體的質量和氣體中的粒子數目之間的關系
(2)氣體相對分子質量的計算
(3)混合氣體
探究活動
摩爾氣體常數的測定
定義1 摩理想氣體在標準狀況下的P0V0/T0值,叫做摩爾體積常數,簡稱氣體常數。符號 R
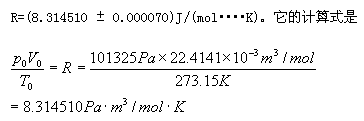
原理 用已知質量的鎂條跟過量的酸反應產生氫氣。把這氫氣的體積、實驗時的溫度和壓強代入理想氣體狀態方程(PV=nRT)中,就能算出摩爾氣體常數R的值。氫氣中混有水蒸氣,根據分壓定律可求得氫氣的分壓(p(H2)=p(總)-p(H2O)),不同溫度下的p(H2O)值可以查表得到。
操作 (1)精確測量鎂條的質量
方法一:用分析天平稱取一段質量約10mg的表面被打亮的鎂條(精確到1mg)。
方法二:取10cm長的鎂帶,稱出質量(精確到0.1g)。剪成長10mm的小段(一般10mm質量不超過10mg),再根據所稱鎂帶質量求得每10mm鎂條的質量。
把精確測得質量的鎂條用細線系住。
(2)取一只10 mL小量筒,配一單孔塞,孔內插入很短一小段細玻管。在量筒里加入2~3mL6mol/L硫酸,然后十分仔細地向筒內緩慢加入純水,沾在量筒壁上的酸液洗下,使下層為酸,上層為水,盡量不混合,保證加滿水時上面20~30mm的水是中性的。
(3)把系有細線的鎂條浸如量筒上層的水里,塞上帶有玻璃管的橡皮塞,使塞子壓住細繩,不讓鎂條下沉,量筒口的水經導管口外溢。這時量筒中和玻璃導管內不應留有氣泡空隙。
(4)用手指按住溢滿水的玻璃導管口,倒轉量筒,使玻璃導管口浸沒在燒杯里的水中,放開手指。這時酸液因密度大而下降,接觸到鎂帶而發生反應,生成的氫氣全部倒扣在量筒內,量筒內的液體通過玻璃導管慢慢被擠到燒杯中。
(5)鎂條反應完后再靜置3~5分鐘,使量筒內的溫度冷卻到室溫,扶直量筒,使量筒內水面跟燒杯的液面相平(使內、外壓強相同),讀出量筒內氣體的體積數。由于氣體的體積是倒置在量筒之中,實際體積要比讀數體積小約0.2mL,所以量筒內實際的氫氣體積VH2=體積讀數-0.20mL(用10mL的量筒量取)
(6)記錄實驗時室內溫度(t℃)和氣壓表的讀數(p大氣)。
計算 (1)根據化學方程式和鎂條的質量算出生成氫氣的物質的量(nH2)
(2) 按下列步驟計算氫氣在標準狀況下的體積。
查表得到室溫下水的飽和蒸氣壓(pH20),用下式計算氫氣的分壓(pH2)